Θετικά αποτελέσματα από μελέτες της μπιμεκιζουμάμπης στη διαπυητική ιδρωταδενίτιδα
Τα πρώτα θετικά αποτελέσματα από δύο μελέτες Φάσης 3, την BE HEARD I και την BE HEARD II, που αξιολογούν την αποτελεσματικότητα και την ασφάλεια της μπιμεκιζουμάμπης σε ενήλικες με διαπυητική ιδρωταδενίτιδα μέτριας έως βαριάς μορφής. 1,2 Τα αποτελέσματα από αυτές τις δύο μελέτες θα αποτελέσουν τη βάση των αιτήσεων προς τις ρυθμιστικές αρχές παγκοσμίως για τη χορήγηση άδειας κυκλοφορίας στη μπιμεκιζουμάμπης για την ένδειξη της διαπυητικής ιδρωταδενίτιδας αρχής γενομένης το τρίτο τρίμηνο του 2023. Η ασφάλεια και η αποτελεσματικότητα της μπιμεκιζουμάμπης στη διαπυητική ιδρωταδενίτιδα δεν έχουν τεκμηριωθεί και η μπιμεκιζουμάμπη δεν έχει εγκριθεί για χρήση στη διαπυητική ιδρωταδενίτιδα από καμία ρυθμιστική αρχή του κόσμου.
Ο Emmanuel Caeymaex, Εκτελεστικός Αντιπρόεδρος, Immunology Solutions and Head of U.S., UCB, δήλωσε: «Είμαστε ενθουσιασμένοι που ανακοινώνουμε θετικά αποτελέσματα από τις κύριες μελέτες Φάσης 3 στη μέτριας έως βαριάς μορφής διαπυητική ιδρωταδενίτιδα, τα οποία υποστηρίζουν την ισχυρή πίστη μας στη μπιμεκιζουμάμπη και αποτελούν τα πρώτα στοιχεία Φάσης 3 που δείχνουν ότι η στόχευση της IL-17F επιπρόσθετα στη στόχευση της IL-17A αποτελεί ενδεχομένως μια υποσχόμενη θεραπευτική προσέγγιση. Ανυπομονούμε να προσφέρουμε πρόσβαση στη μπιμεκιζουμάμπη σε άτομα που πάσχουν από αυτή τη χρόνια φλεγμονώδη νόσο το συντομότερο δυνατό».
Και στις δύο μελέτες, η μπιμεκιζουμάμπη πέτυχε το πρωτεύον καταληκτικό σημείο, επιδεικνύοντας στατιστικά σημαντικές και σταθερές κλινικά ουσιαστικές βελτιώσεις, σε σύγκριση με το εικονικό φάρμακο, όσον αφορά το ποσοστό των ασθενών που πέτυχαν κλινική ανταπόκριση της διαπυητικής ιδρωταδενίτιδας (HiSCR50) την εβδομάδα 16. 1,2
«Η διαπυητική ιδρωταδενίτιδα είναι μια χρόνια, επώδυνη και εξουθενωτική φλεγμονώδης νόσος του δέρματος που επηρεάζει τη σωματική, ψυχολογική και κοινωνική ευημερία των ασθενών. Αυτή η υποβάθμιση της ποιότητας ζωής ενισχύεται από τις περιορισμένες θεραπευτικές επιλογές που είναι διαθέσιμες αυτή τη στιγμή», είπε ο Καθηγητής Gregor Jemec, MD, Ph.D., Προέδρος του Τμήματος Δερματολογίας στο Πανεπιστήμιο του Zeeland στο Roskilde της Δανίας. Συμπληρώνοντας δήλωσε ό,τι «Τα πρώτα θετικά κλινικά αποτελέσματα από τις μελέτες BE HEARD I και BE HEARD II είναι ενθαρρυντικά και καταδεικνύουν την αξία που ενδέχεται να έχει η μπιμεκιζουμάμπη για την κοινότητα των ατόμων με διαπυητική ιδρωταδενίτιδα».
Αναλυτικά αποτελέσματα από τις μελέτες BE HEARD I και BE HEARD II θα παρουσιαστούν σε επερχόμενη επιστημονική συνάντηση και θα δημοσιευθούν σε έγκριτη ιατρική επιθεώρηση.
Σχετικά με τη μελέτη BE HEARD I
Η BE HEARD I είναι μία τυχαιοποιημένη, διπλά τυφλή, ελεγχόμενη με εικονικό φάρμακο, παράλληλων ομάδων, πολυκεντρική μελέτη Φάσης 3 που έχει σχεδιαστεί για την αξιολόγηση της αποτελεσματικότητας και της ασφάλειας της μπιμεκιζουμάμπης σε ενήλικες με μέτριας έως βαριάς μορφής διαπυητική ιδρωταδενίτιδα. 3 Στη μελέτη BE HEARD I εντάχθηκαν 505 συμμετέχοντες με διάγνωση διαπυητικής ιδρωταδενίτιδας μέτριας έως βαριάς μορφής. 3 Για περισσότερες λεπτομέρειες σχετικά με τη μελέτη, επισκεφτείτε το BE HEARD I στον ιστότοπο clinicaltrials.gov. 3
Σχετικά με τη μελέτη BE HEARD IΙ
Η BE HEARD IΙ είναι μία τυχαιοποιημένη, διπλά τυφλή, ελεγχόμενη με εικονικό φάρμακο, παράλληλων ομάδων, πολυκεντρική μελέτη Φάσης 3 που έχει σχεδιαστεί για την αξιολόγηση της αποτελεσματικότητας και της ασφάλειας της μπιμεκιζουμάμπης σε ενήλικες με διαπυητική ιδρωταδενίτιδα μέτριας έως βαριάς μορφής.4 Στη μελέτη BE HEARD IΙ εντάχθηκαν 509 συμμετέχοντες με διάγνωση διαπυητικής ιδρωταδενίτιδας μέτριας έως βαριάς μορφής.4 Για περισσότερες λεπτομέρειες σχετικά με τη μελέτη, επισκεφτείτε το BE HEARD II στον ιστότοπο clinicaltrials.gov.4
Σχετικά με τη διαπυητική ιδρωταδενίτιδα
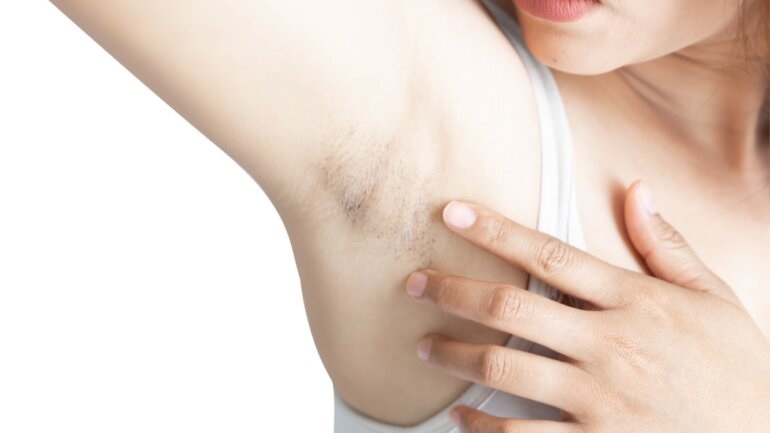
Η διαπυητική ιδρωταδενίτιδα (ΔΙ) είναι μια χρόνια, υποτροπιάζουσα, επώδυνη και εξουθενωτική φλεγμονώδης νόσος του δέρματος. 5,6 Τα κύρια συμπτώματα είναι οζίδια, αποστήματα και συρίγγια (κανάλια που οδηγούν έξω από το δέρμα) που παροχετεύουν πύον τα οποία εμφανίζονται συνήθως στις μασχάλες, στη βουβωνική χώρα και στους γλουτούς. 5,6 Τα άτομα με ΔΙ βιώνουν εξάρσεις της νόσου καθώς και έντονο πόνο, που μπορούν να έχουν σημαντικό αντίκτυπο στην ποιότητα ζωής.
Η ΔΙ αναπτύσσεται στην πρώιμη ενήλικη ζωή, επηρεάζει περίπου το ένα τοις εκατό του πληθυσμού στις περισσότερες χώρες που μελετήθηκαν και είναι τρεις φορές πιο συχνή στις γυναίκες από ότι στους άνδρες. 5,6 Περίπου το ένα τρίτο των ατόμων με ΔΙ έχουν οικογενειακό ιστορικό ΔΙ και παράγοντες που σχετίζονται με τον τρόπο ζωής, όπως το κάπνισμα και η παχυσαρκία, που μπορούν επίσης να παίξουν καθοριστικό ρόλο στην κλινική πορεία της ΔΙ. 7
Τα συμπτώματα του πόνου, των εκκρίσεων και των ουλών δεν επιφέρουν μόνο σωματική επιβάρυνση. Τα άτομα με ΔΙ βιώνουν επίσης στιγματισμό: ανησυχούν ή βιώνουν ευθέως αρνητικές συμπεριφορές και αντιδράσεις από την κοινωνία εξαιτίας των συμπτωμάτων τους. 8 Αυτά τα συναισθήματα μπορεί να οδηγήσουν σε ντροπή, κοινωνική απομόνωση, χαμηλή αυτοεκτίμηση και διαταραχή της σεξουαλικής ζωής και να επηρεάσουν όλους τους τομείς της ζωής, συμπεριλαμβανομένων των διαπροσωπικών σχέσεων, της εκπαίδευσης και της εργασίας. 5,7
Σχετικά με τη μπιμεκιζουμάμπη
Η μπιμεκιζουμάμπη είναι ένα εξανθρωποποιημένο μονοκλωνικό αντίσωμα IgG1 το οποίο έχει σχεδιαστεί για να αναστέλλει εκλεκτικά τόσο την ιντερλευκίνη 17A (IL-17A) όσο και την ιντερλευκίνη 17F (IL-17F), δύο βασικές κυτταροκίνες που καθοδηγούν τις φλεγμονώδεις διεργασίες. 9
Τον Αύγουστο του 2021, η μπιμεκιζουμάμπη εγκρίθηκε στην Ευρωπαϊκή Ένωση (ΕΕ)/στον Ευρωπαϊκό Οικονομικό Χώρο (ΕΟΧ) και στη Μεγάλη Βρετανία για τη θεραπεία της μέτριας έως σοβαρής ψωρίασης κατά πλάκας σε ενήλικες οι οποίοι είναι υποψήφιοι για συστηματική θεραπεία. 10,11 Οι πληροφορίες της επισήμανσης μπορεί να διαφέρουν σε άλλες χώρες. Παρακαλούμε ελέγξτε τις τοπικές πληροφορίες συνταγογράφησης.
Μπιμεκιζουμάμπη Σημαντικές Πληροφορίες Ασφάλειας για την Ψωρίαση στην ΕΕ/τον ΕΟΧ
Οι πιο συχνά αναφερόμενες ανεπιθύμητες ενέργειες με τη μπιμεκιζουμάμπη ήταν λοιμώξεις του ανώτερου αναπνευστικού συστήματος (14,5%) (πιο συχνά ρινοφαρυγγίτιδα) και στοματική καντιντίαση (7,3%). Συχνές ανεπιθύμητες ενέργειες (≥1/100 έως <1/10) ήταν η στοματική καντιντίαση, οι δερματοφυτικές λοιμώξεις, οι λοιμώξεις των ώτων, οι λοιμώξεις απλού έρπητα, η στοματοφαρυγγική καντιντίαση, η γαστρεντερίτιδα, η θυλακίτιδα, η κεφαλαλγία, η δερματίτιδα και το έκζεμα, η ακμή, οι αντιδράσεις στο σημείο ένεσης και η κόπωση. Οι ηλικιωμένοι είναι ίσως πιθανότερο να παρουσιάσουν ορισμένες ανεπιθύμητες αντιδράσεις, όπως στοματική καντιντίαση, δερματίτιδα και έκζεμα όταν χρησιμοποιούν μπιμεκιζουμάμπη.
Η μπιμεκιζουμάμπη αντενδείκνυται σε ασθενείς με υπερευαισθησία στη δραστική ουσία ή σε κάποιο από τα έκδοχα και σε ασθενείς με κλινικά σημαντικές ενεργές λοιμώξεις (π.χ. ενεργή φυματίωση).
Η μπιμεκιζουμάμπη μπορεί να αυξήσει τον κίνδυνο λοιμώξεων. Η θεραπεία με μπιμεκιζουμάμπη δεν πρέπει να χορηγείται σε ασθενείς με οποιαδήποτε κλινικά σημαντική ενεργή λοίμωξη. Στους ασθενείς που λαμβάνουν θεραπεία με μπιμεκιζουμάμπη θα πρέπει να δίδονται οδηγίες προκειμένου να ζητήσουν ιατρική συμβουλή, εάν εμφανιστούν σημεία ή συμπτώματα ενδεικτικά λοίμωξης. Πριν από την έναρξη της θεραπείας με μπιμεκιζουμάμπη, οι ασθενείς θα πρέπει να αξιολογηθούν για λοίμωξη από φυματίωση (ΤΒ). Η μπιμεκιζουμάμπη δεν θα πρέπει να χορηγείται σε ασθενείς με ενεργό ΤΒ και οι ασθενείς που λαμβάνουν μπιμεκιζουμάμπη θα πρέπει να παρακολουθούνται για σημεία και συμπτώματα ενεργού TB.
Έχουν αναφερθεί νέα περιστατικά ή περιστατικά εξάρσεων φλεγμονώδους νόσου του εντέρου με την μπιμεκιζουμάμπη. Η μπιμεκιζουμάμπη δεν συνιστάται σε ασθενείς με φλεγμονώδη νόσο του εντέρου. Εάν ένας ασθενής αναπτύξει σημεία και συμπτώματα φλεγμονώδους νόσου του εντέρου ή παρουσιάσει έξαρση προϋπάρχουσας φλεγμονώδους νόσου του εντέρου, η χορήγηση της μπιμεκιζουμάμπης θα πρέπει να διακοπεί και να ξεκινήσει η κατάλληλη ιατρική αντιμετώπιση.
Έχουν παρατηρηθεί σοβαρές αντιδράσεις υπερευαισθησίας, συμπεριλαμβανομένων αναφυλακτικών αντιδράσεων, με τους αναστολείς IL-17. Εάν εμφανιστεί σοβαρή αντίδραση υπερευαισθησίας, η χορήγηση της μπιμεκιζουμάμπης θα πρέπει να διακοπεί αμέσως και να ξεκινήσει κατάλληλη θεραπεία.
Δεν θα πρέπει να χορηγούνται ζώντα εμβόλια σε ασθενείς που λαμβάνουν θεραπεία με μπιμεκιζουμάμπη.
Παρακαλείσθε να συμβουλευτείτε την περίληψη των χαρακτηριστικών του προϊόντος σχετικά με άλλες ανεπιθύμητες ενέργειες, τις πλήρεις πληροφορίες για την ασφάλεια και τη συνταγογράφηση. https://www.ema.europa.eu/en/documents/product-information/bimzelx-epar-product-information_en.pdf
Ημερομηνία αναθεώρησης της περίληψης των χαρακτηριστικών του προϊόντος στην ΕΕ: Δεκέμβριος 2022. Το φάρμακο αυτό τελεί υπό συμπληρωματική παρακολούθηση. Αυτό θα επιτρέψει τον γρήγορο προσδιορισμό νέων πληροφοριών ασφάλειας. Ζητείται από τους επαγγελματίες υγείας να αναφέρουν οποιεσδήποτε πιθανολογούμενες ανεπιθύμητες ενέργειες
Βιβλιογραφικές αναφορές
- BE HEARD I Phase 3 Study, UCB Data on file, December 2022.
- BE HEARD II Phase 3 Study, UCB Data on file, December 2022.
- ClinicalTrials.gov. A study to test the efficacy and safety of bimekizumab in study participants with moderate to severe hidradenitis suppurativa (BE HEARD I). Available at: https://clinicaltrials.gov/ct2/show/NCT04242446. Last accessed: December 2022.
- ClinicalTrials.gov. A Study to Test the Efficacy and Safety of Bimekizumab in Study Participants With Moderate to Severe Hidradenitis Suppurativa (BE HEARD II). Available at: https://clinicaltrials.gov/ct2/show/NCT04242498. Last accessed: December 2022.
- Jemec GBE. Clinical practice. Hidradenitis suppurativa. N Engl J Med. 2012;366(2):158-164.
- Sabat R, Jemec GBE, Matusiak L, et al. Hidradenitis suppurativa. Nat Rev Dis Primers. 2020;6(1);18
- Kokolakis G, Wolk K, Schneider-Burrus S et al. Delayed Diagnosis of Hidradenitis Suppurativa and Its Effect on Patients and Healthcare System. Dermatology. 2020;236(5):421–430.
- Koumaki D, Efthymiou O, Bozi E, et al. Perspectives On Perceived Stigma And Self-Stigma In Patients With Hidradenitis Suppurativa. Clin Cosmet Investig Dermatol 2019:12:785–790.
- Glatt S, Helmer E, Haier B, et al. First-in-human randomized study of bimekizumab, a humanized monoclonal antibody and selective dual inhibitor of IL-17A and IL-17F, in mild psoriasis. Br J Clin Pharmacol. 2017;83(5):991-1001.
- BIMZELX® (bimekizumab) EU Summary of Product Characteristics, December 2022.
https://www.ema.europa.eu/en/documents/product-information/bimzelx-epar-product-information_en.pdf. Last accessed: December 2022. - BIMZELX® (bimekizumab) GB Summary of Product Characteristics, May 2022.
https://www.medicines.org.uk/emc/product/12834; https://www.medicines.org.uk/emc/product/12833. Last accessed: December 2022.
Αναπαραγωγή άρθου από εδώ